

미래창조과학부는 국내연구진이 활성산소의 농도에 따라 조절되는 분자스위치를 찾아내고 세포의 생사를 결정하는 원리를 규명해 냈다고 8일 밝혔다.
활성산소는 인체 대사활동에 의해 발생되는 산소 부산물로, 세포의 성장과 분화를 돕고 염증을 억제하는 유익한 기능을 하지만 세포손상을 유발해 암, 당뇨 등 여러 질병을 일으키고 노화를 촉진시키는 것으로 알려져 있다. 이처럼 세포를 죽이기도 하고 살리기도 하는 활성산소의 상반된 역할을 설명할 수 있는 실마리를 찾아낸 것.
미래부에 따르면 이번 연구는 카이스트(KAIST) 바이오및뇌공학과 조광현 석좌교수가 주도하고 이호성 연구원, 황채영 박사, 신성영 박사가 참여했으며 한국생명공학연구원 권기선 박사가 공동으로 수행했다.
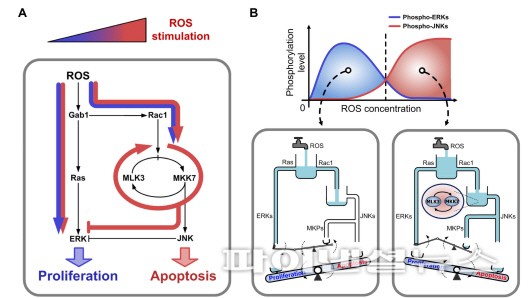
연구팀은 MLK3(세포 사멸에 관여하는 단백질 인산화 효소)이 매개하는 양성피드백 회로가 활성산소 농도에 대한 ERK(세포 증식에 관여하는 신호전달 분자)와 JNK(세포 사멸에 관여하는 신호전달 분자) 경로간 신호흐름 균형을 조절함으로써 세포의 생사를 가르는 분자스위치임을 알아냈다.
연구팀에 따르면 활성산소 농도가 낮을 때는 세포증식에 관여하는 ERK 단백질이 활성화되는 반면 활성산소 농도가 높아지면 세포사멸에 관여하는 JNK 단백질이 활성화됐다.
이는 적절한 스트레스 환경에서는 ERK 단백질이 활성화되어 세포가 분열하도록 신호를 보내는 반면, 과도한 스트레스 상황에서는 JNK 단백질이 활성화되어 분열을 멈추고 세포가 죽도록 유도한다는 게 연구팀의 설명이다.
조광현 교수는" IT와 BT의 융합연구인 시스템생물학 연구를 통해 수수께끼로 남아있던 활성산소에 대한 상반된 세포반응의 원리를 규명했다"며 "향후 활성산소로 인한 노화나 암을 극복하기 위한 연구에 활용될 것"이라고 밝혔다.
한편, 이번 연구는 미래창조과학부가 추진하는 중견연구자지원사업(도약)과 바이오·의료기술개발사업의 지원으로 수행됐으며 연구결과는 사이언스 자매지인 '사이언스 시그널링'지 6월 3일자에 게재됐다.
bbrex@fnnews.com 김혜민 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지

