보령제약.유한양행 등 임상 승인 등 개발 박차
'3세대 항암제'로 불리는 면역항암제의 국내 시장 경쟁이 더욱 치열해질 전망이다. 국내 면역항암제 시장은 글로벌제약사인 BMS의 '옵디보'와 MSD의 '키트루다'가 양분하고 있는 가운데 로슈의 '티쎈트릭'이 뒤를 잇고 있다. 여기에 국내 제약사인 동아에스티, 보령제약, 유한양행 등이 개발에 박차를 가하면서 글로벌 제약사에 도전장을 던지고 있다.
■BMS.MSD, 국내 면역항암제 시장 양분
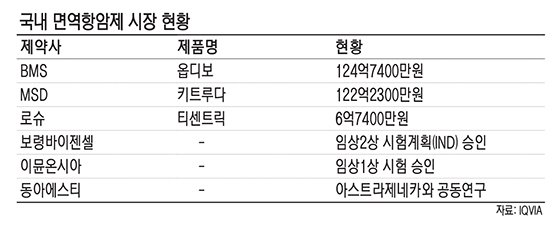
26일 의약품 시장조사기관 아이큐비아에 따르면 지난해 BMS '옵디보'의 국내 매출은 124억7400만원으로 국내 면역항함제 시장에서 1위를 기록했다. 2위는 MSD의 '키트루다'로 122억2300만원을 달성했다. 3위인 로슈의 티센트릭은 6억7400만원을 기록했다.
옵디보와 키트루다는 지난해 8월 비소세포폐암 2차 치료제로 건강보험이 적용됐다. 이후 각 제품의 매출을 살펴보면 옵디보가 전년 67억원 대비 85.8% 성장했으며, 키트루다는 전년 대비 11.2% 올랐다. 두 제품은 같은 시기에 건강보험 적용을 받았지만 적용 기준의 차이가 매출에 영향을 미쳤다. 옵디보의 급여 혜택을 받는 환자는 이전 백금기반 화학요법에 실패한 국소 진행성 또는 전이성 비소세포폐암 환자 중 PD-L1(암세포 표면 단백질) 발현율이 10% 이상인 환자이다. 키트루다는 PD-1 발현율이 50%이상인 환자인 경우 보험 급여를 받을 수 있다. 즉, 옵디보가 급여를 받을 수 있는 환자 폭이 더 넓다.
향후 BMS와 MSD는 자사 면역항암제 확대 전략에도 차이를 보이고 있다. 옵디보는 현재 7개 암종에서 8가지 적응증을 획득, 국내 면역항암제 중에서는 가장 많은 암종에 적응증을 가지고 있다. 지난 23일 면역항암제 중 최초로 위 선암에서 적응증을 허가 받았고 미국에서는 대장암 및 간암 치료제로도 허가됐다. 현재 국내에서 대장암과 간암 적응증은 아직 승인 전이다. 반면 키트루다는 1차 치료제로 적응증 확대를 꾀하고 있다. 1차 치료제로 확대되면 좀 더 많은 환자에게 사용이 가능해지는 셈이다.
■국내 제약사도 면역항암제 개발 박차
면역항암제가 각광을 받으면서 국내 제약사들도 개발을 서두르고 있는 모습이다. 국내 제약사 중에는 보령제약이 가장 앞서고 있다. 보령제약의 자회사인 보령바이젠셀은 개발 중인 면역세포치료제에 대해 지난해 말 식품의약품안전처로부터 임상2상 시험계획(IND)을 승인받았다. 엡스타인 바 바이러스(EBV)에 의해 혈액암인 NK.T 림프종에 걸린 환자가 대상이다. 보령바이젠셀은 2021년 임상2상 완료 후 품목허가 및 출시를 목표로 하고 있다.
유한양행의 자회사 이뮨온시아도 지난 1일 식약처로부터 면역항암제 'IMC-001'에 대한 임상 1상 시험 승인을 받았다. PD-1 및 PD-L1 면역관문 억제제에 대한 국산 신약으로서는 처음이다.
동아에스티는 지난 1월 미국에서 열린 'JP모건 헬스케어 콘퍼런스'에서 영국계 제약사 아스트라제네카와 면역항암제 공동연구 계약을 체결했다. 동아에스티는 아스트라제네카가 연구 중인 3가지 면역항암제 타깃에 대한 선도물질 및 후보물질을 도출하는 물질탐색 연구를 공동으로 진행한다. 이번 공동연구로부터 도출되는 모든 지적재산과 특허는 공동소유를 하기로 했다. 업계 관계자는 "면역항암제는 글로벌 제약사들도 개발에 성공한 회사가 5곳 밖에 안될 정도로 쉽지 않다"며 "다만 관련 기술의 축적과 개발에 나서는 국내 제약사들도 있다는 점에서 국산 제품도 수 년 내 나오길 기대한다"고 말했다.
leeyb@fnnews.com 이유범 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지

