인보사 허가 취소후 관심 쏠려
신약 네이처셀 '조인트스템'
바이오솔루션 '카티라이프'
엘앤씨바이오 '메가카티' 임상
통증 심한 K-L 3단계 치료 기대
순천향대서울병원 정형외과 김용범 교수는 "퇴행성 무릎 관절염 K-L 그레이드 3단계 환자의 경우 수술 전단계라 통증이 가장 심하지만 현재 환자에게 사용할 치료제가 없다"며 "새로운 치료제가 개발되면 환자 치료에 도움이 될 것"이라고 말했다.
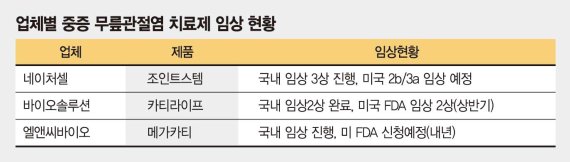
28일 제약바이오업계에 따르면 네이처셀 '조인트스템', 바이오솔루션 '카티라이프', 엘앤씨바이오 메가카티 등 중증 무릎관절염 치료제가 국내와 해외에서 임상을 진행하고 있다.
네이처셀의 관계사 알바이오는 퇴행성관절염 치료제 '조인트스템'이 최근 미국 식품의약국(FDA)의 1차 관문을 통과했다고 밝혔다. 이 치료제는 K-L 그레이드 3단계 환자가 대상으로 환자의 지방조직에서 채취한 중간엽 줄기세포를 배양해 주사제 형태로 무릎에 투여한다. 알바이오는 지난해 9월 미국 현지 임상시험 대행기관(CRO)와 임상 프로토콜 개발을 마쳤다. 지난해 12월엔 FDA와 서면 미팅을 끝냈다.
조인트스템 개발책임자인 라정찬 박사는 "최종 임상시험 계획서를 3월까지 FDA에 제출할 계획"이라며 "올해 국내 3상 임상결과와 미국에서 시행할 2b/3a 임상 결과를 바탕으로 RMAT(신속 승인제도) 지정을 요청할 예정"이라고 말했다.
이 치료제는 일본에서 재생의료법에 따라 치료 승인을 받아 니시하라클리닉에서 2015년 11월부터 현재까지 약 1000명의 퇴행성관절염 환자에게 투약한 바 있다.
바이오솔루션은 지난해 11월 FDA로부터 관절연골 재생 세포치료제 카티라이프의 2상 임상시험계획(IND)에 대해 승인받았다. 이 제품은 지난해 국내 식품의약품안전처에서 2상 임상 허가를 받아 임상을 진행한 바 있다. 바이오솔루션은 국내 임상 결과를 바탕으로 FDA에 임상 2상 단계로 바로 진입해 임상 개발비 절감은 물론 세계시장에 조기에 출시할 수 있는 기회를 얻게 됐다.
임상은 국제연골재생학회의 ICRS그레이드에서 가장 높은 3~4등급(0~4) 환자와 K-L 그레이드 3단계 환자로 중증 무릎 관절염 환자가 대상이다. 환자 수는 카티라이프 25명, 대조군 25명으로 임상시험 기간은 약 3년이 걸릴 것으로 예상하고 있다.
바이오솔루션 관계자는 "올해 상반기 내에 미국 임상을 진행하기 위해 CRO 업체를 선정해 임상 일정을 잡고 있다"며 "국내 결과와 미국 임상 2상 결과를 기반으로 라이선스 아웃 또는 현지 빅 파마와의 협업을 통한 임상 3상을 진행할 것"이라고 밝혔다.
엘앤씨바이오는 지난해 12월 식약처로부터 무릎 연골 관절염 치료제인 '메가카티'의 임상시험 계획을 승인받아 올해 임상시험을 진행한다. 이 제품은 '켈그렌-로렌스 체계 3단계'와 ICRS그레이드 3~4등급 무릎 관절염 환자의 손상 부위에 직접 동종연골세포를 주사로 주입해 즉시 연골을 개선시켜준다.
임상시험은 환자군 45명, 대조군 45명을 대상으로 신촌세브란스병원, 강남세브란스병원, 고려대 안암병원, 국민건강보험공단 일산병원 등 4개 병원에서 진행된다.
엘앤씨바이오 관계자는 "메가카티는 세계 최초 인체 유래 초자연골 기반 연골 치료용 의료기기"라며 "올해 1년간 임상을 진행하면 내년 상반기에는 제품을 출시할 수 있을 것"이라고 밝혔다.
엘앤씨바이오는 국내 임상을 마친 후 2020년 말이나 2021년 초에 미국 FDA에 임상시험을 신청할 계획이다.
pompom@fnnews.com 정명진 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지

