국내 최초 임상 3상 진행, 471명 환자 등록 95% 완료
올해 안에 식품의약품안전처 품목허가 신청

20일 지엔티파마에 따르면 넬로넴다즈는 현재 국내 24개 대학병원에서 임상 3상 시험이 진행 중으로, 등록 환자 수가 현재 471명으로 95%의 진행률을 보이고 있다.
이에 따라 4월 이내에 환자 등록이 모두 완료될 것으로 예상돼 올해 안에 식품의약품안전처에 품목허가를 신청한다는 계획이다.
임상 3상 환자 등록 95% 완료…내년 하반기 치료제 출시
지엔티파마가 과학기술정보통신부 등의 지원을 받아 개발한 뇌졸중 치료제 넬로넴다즈는 NMDA 수용체 활성을 억제하고 활성산소를 제거하는 합성신약으로, 뇌졸중 후 뇌세포 사멸을 방지하는 세계 최초 다중표적 뇌세포 보호 약물이다.
지난 2021년 8월 식품의약품안전처로부터 국내 최초로 임상 3상 임상시험계획서를 승인받아 24개 대학병원에서 임상을 진행하고 있다.
중증도 및 중증 허혈성 뇌졸중으로 판정된 환자 496명을 대상으로 진행하고 있으며 현재 임상 3상 등록 환자 수는 471명으로(95%) 늦어도 4월 이내에 환자 등록이 모두 완료될 것으로 전망된다.
넬로넴다즈의 안전성과 약효는 그동안 진행된 임상시험에서 입증됐다.
발병 후 8시간 이내에 혈전제거술을 받은 중등도 이상의 뇌졸중 환자 208명을 대상으로 완료한 임상 2상에서 넬로넴다즈 투여군은 플라시보 투여군에 비해 장애가 개선됐다.
넬로넴다즈 임상 2상 결과는 지난해 11월 세계 최고 권위의 뇌졸중 학술지 ‘Stroke(IF 10.17)’에, 현재 진행 중인 임상 3상 프로토콜은 ‘Journal of Stroke (IF 8.631)’ 최신호(1월)에 게재됐다.
지엔티파마는 환자 등록이 완료되면 임상 결과 보고서를 작성, 올해 안에 식품의약품안전처에 품목허가를 신청해 이르면 내년 하반기쯤 치료제를 출시할 계획이다.
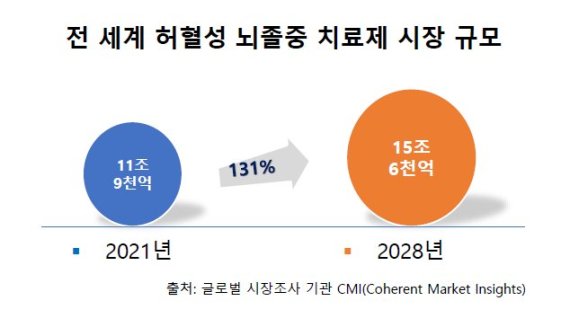
15조원 뇌졸중 치료제 개발 시장 '지각변동 예고'
지엔티파마의 넬로넴다즈가 개발에 성공할 경우 국내 기업으로는 유일하게 15조6000억원에 달하는 전 세계 뇌졸중 치료제 시장의 변화를 예고하는 신약이 탄생하게 된다.
미국의 글로벌 시장 조사기관 CMI에 따르면 전 세계 허혈성 뇌졸중 치료제 시장 규모는 2021년 11조9000억원에서 2028년 15조6000억원으로 30% 이상 증가할 것으로 전망했다.
현재 중국에서 지난 2003년 승인돼 처방되는 뇌졸중 치료제 에다라본의 매출액은 2019년 기준 52억위안(한화 약 9300억원)에 달하는 것으로 알려졌다.
에다라본은 일본 미쓰비시다나베에서 개발한 항산화제로, 지난 2002년 일본에서 뇌졸중 치료제로 승인됐다.
정부 5년 이내 블록버스터급 신약 개발 기대
이런 가운데 정부는 오는 2027년까지 블록버스터 신약 2개를 개발한다는 계획을 밝히면서 국내 제약·바이오 업계의 연구개발 움직임도 한층 빨라지고 있다.
이를 위해 정부는 2030년까지 국가신약개발사업에 2조2000억원을 지원하고 제약·바이오 업체의 글로벌 진출을 위해 1조원 규모의 메가 펀드(K-바이오백신 펀드)를 조성하는 등 바이오헬스산업 6대 강국 도약을 준비하고 있다.
하지만 신약을 개발하는 데 적어도 20년 내지 30년이 필요하다는 측면을 고려하면 블록버스터 신약 개발에 성공하는 기업은 한정될 것으로 업계는 내다보고 있다.
지엔티파마 관계자는 "지난 1998년 뇌과학, 약리학 등 분야 교수 8명이 설립한 지엔티파마는 25년간 뇌졸중 및 알츠하이머 치매를 치료할 수 있는 뇌세포 보호 신약 개발에 매진하며 가시적인 성과를 거두고 있다"며 "최고의 임상 연구진과 함께 임상 3상을 성공적으로 완료해 빠르면 2024년 하반기에 치료제를 출시할 계획"이라고 밝혔다.
jjang@fnnews.com 장충식 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지


